高分子
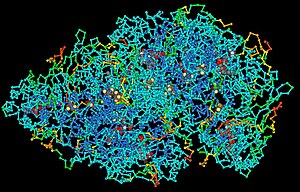
蛋白质高分子。
高分子(Macromolecule)化合物是一個非常大的分子,如蛋白質,通常由較小的亞基(單體)的聚合產生。它們一般由數千或更多的原子組成。通过一定形式的聚合反应生成具有非常高的分子量的大分子,一般指聚合物和结构上包括聚合物的分子。在生物化学中,这个术语被应用于三个传统的生物聚合物(核酸、蛋白质、和碳水化合物),[1]以及具有大分子量的非聚合分子,例如脂类和大环化合物。这些分子有时也被称为生物大分子。
聚合物高分子的各个构成分子被称为单体。
人工合成的高分子包括塑料。金属和晶体虽然也是由许多原子组成的,其内部通过类似分子的键联合在一起,但是它们一般不被认为是高分子。有时不同的高分子之间通过分子间力(但不是通过化学键)组合到一起,尤其是假如这样的组合是自然发生的,而且其组成部分一般不单独出现的话,那么这样的混合物也会被称为高分子。实际上这样的混合物更应该被称为高分子复合物。在这种情况下组成这个复合物的单个高分子往往被称为下单位。由高分子组成的物质往往有不寻常的物理特性。液晶和橡胶就是很好的例子。许多高分子在水中需要特殊的小分子帮助才能溶解。许多需要盐或者特殊的离子来溶解。
目录
1 用途
2 性质
3 有機高分子
3.1 碳水化合物
3.1.1 单糖
3.1.2 双糖
3.1.3 多糖
3.2 脂类
3.2.1 脂肪
3.2.1.1 饱和脂肪酸
3.2.1.2 不饱和脂肪酸
3.2.2 磷脂
3.3 类固醇
3.4 蛋白质
3.4.1 氨基酸
3.5 核酸
3.5.1 碱基对
4 無機高分子
4.1 天然無機高分子
4.2 合成無機高分子
5 参考文献
6 参见
7 外部链接
用途
"高分子"这个术语由诺贝尔奖获得者赫尔曼·施陶丁格于1920年代创造的,尽管他发表的第一篇相关领域的文章只是提到"高分子化合物"(超过1000个原子)。[2].那时,"聚合物"这一习惯用法由贝采利乌斯于1833年提出,和现在的意思不同:它只是同分异构的另一个形式,比如说苯和乙炔,而与大小无关。[3].
这一术语用来描述大分子在不同领域中的不同形式。比如,生物学中高分子指的是组成生物的四种大分子,而从化学来说,这个属于指的是两种或以上由分子间力聚集在一起而不是共价键,不过两者分得并不那么清。[4]
根据IUPAC推荐的定义,"高分子"用在聚合物科学中仅仅指的是单一分子。比如说,一个聚合分子写成“大分子”或者“聚合物分子”很合适,而不应该用表示一个由大分子组成的物质的“聚合物”。[5]

由米伦等报告的聚苯类树状物高分子结构[6]
由于大分子很大,仅仅用计量学很难描述。比如均聚物等简单大分子的结构可以表述为单一单体和总摩尔质量。另一方面,复杂的生物大分子需要多方面的结构描述,比如结构的层次来描述蛋白质
性质
由大分子构成的物质经常具有不寻常的物理性质。尽管很小很难看到,在溶液中可以通过普通的吸管切断溶液而将单一片段DNA破裂成2个简单的分子。这并不是真正的小分子。1964年版的萊納斯·鮑林《大学化学》断言,从本质上,DNA不会超过5000个碱基对。这是因为生物化学家无意中一贯地把他们的样品破碎成片段。实际上,DNA的染色体能够有上亿个碱基对长。
另外一个大分子常见的性质是和小分子不同,必须依靠帮助才能溶解到溶液中,许多大分子必需盐或者特殊的离子溶于水。如果溶液的浓度过高或者过低,蛋白质会改性。
溶液中的高浓度大分子能够通过大分子群集效应改变其他大分子反映的速率和平衡常数。[7]这是因为大分子从大部分溶液体积中排除其他分子,从而增加这些分子的有效浓度。
有機高分子
碳水化合物
单糖
- 细胞的主要成分
- 可由光合作用产生
- 在其化学键中为细胞呼吸存储能量
- 碳在骨架中的数量一般有三到五个:
- 三个碳:丙糖
- 五个碳:戊糖出现于DNA和RNA中,核糖
- 六个碳:己糖(如:葡萄糖,乳糖,果糖)
- 三个碳:丙糖
- 结构:一个碳元素双键一个氧元素,其他的碳元素和羟基相链。
椅式构象或环(葡萄糖,如果羟基在环下为α,如果羟基在环上为β)
双糖
- 有两个单体构成,糖苷键链接而成
- 糖苷键由缩合反应形成
- 葡萄糖+葡萄糖=麦芽糖
- 葡萄糖+果糖=蔗糖
- 葡萄糖+半乳糖=乳糖
- 葡萄糖+葡萄糖=麦芽糖
多糖
- 由成百到几万个单体构成
- 用于存储热量和结构
几种多糖:
- 植物中
淀粉- 由α葡萄糖构成
- 分子结构中没有分支
- 形成螺旋形
纤维素- β葡萄糖
- 分子结构中没有分支
- 加强植物的细胞壁
- 不能分泌能打断β糖苷键的酶的动物不能消化
- 壳多糖
- 多存在于节肢动物外壳上:蜘蛛,甲壳虫,螃蟹,昆虫等。
脂类
- 不是多糖,不由缩合反应构成
- 不溶于水
脂肪:能量储存
磷脂:细胞膜主要成分
类固醇:胆固醇,荷尔蒙
脂肪
脂肪分子由一个甘油和三个脂肪酸构成。有很长的烃链(16至18个碳元素),烃链结束羧酸。正由于烃链的原因,脂肪分子中大部分键为非极性,因此不溶于水。脂肪酸分为脂肪饱和酸和不饱和脂肪酸。
饱和脂肪酸
- 没有碳碳双键
- 氢元素的数量最大
- 直链,因此密度大,室温下为固体
不饱和脂肪酸
- 有碳碳双键
- 骨架中有拐弯处(碳碳双键)
- 密度小,室温下为液体
功能
- 保存能量,效率是多糖的两倍
- 保护内脏
- 防止热量流失(鲸和海豚)
磷脂

微团
磷脂结构为一个甘油,两个脂肪酸和一个磷群,因此磷脂部分溶于水(磷群),部分不溶于水(脂肪酸)。由于这种半溶半不溶的性质,在水中不溶于水的脂肪酸朝内,易溶的磷群朝外,围成一个圈,形成微团。在细胞膜中,形成磷脂双层体。
类固醇
类固醇结构在碳构架中,有四个融合的碳环。胆固醇广泛存在于动物体的细胞膜中,同时也是合成几种重要类固醇的材料。
蛋白质

肽链
细胞的构成材料。蛋白质是由氨基酸通过肽键有序连接而形成的多肽链。蛋白质的基本单位是氨基酸,氨基酸的氨基和羧基缩合失水后形成肽键,由三个或三个以上氨基酸残基组成的肽称为多肽形成多肽链。
作用:
- 支撑结构:动物连接组织中的胶原质。
- 运输:血色素,钾钠腺苷三磷酸酶(Hydrogen potassium ATPase)。
激素:胰岛素- 运动:肌动蛋白
- 防御:抗体
催化。蛋白质的一个重要功能就是作为生物催化剂,酶。
蛋白质的分子结构可划分为四级:
一级结构:组成多肽链的线性氨基酸序列。
二级结构:α螺旋、β折叠、β转角。
三级结构:由一条多肽链的不同氨基酸侧链间的相互作用形成的稳定结构。
四级结构:由不同蛋白质亚基间相互作用形成具有功能的蛋白质分子。
氨基酸

甘胺酸
氨基酸是蛋白质的单体,氨基酸的多体(氨基酸数量在30个以下)叫做多肽,蛋白质则由30-50个以上的氨基酸构成。
氨基酸由四个化合物连接于中央的碳元素构成:氢原子、羧基、氨基、侧链。
核酸
保存并传递遗传信息。有核糖核酸与脱氧核糖核酸两种,染色体有脱氧核糖核酸构成,内有上十万个基因。不直接出现于蛋白质的合成过程中,DNA-RNA-蛋白质,一次建立起自己的复制。含氮元素的环有两种:嘧啶和嘌呤。嘧啶为六元环,在DNA中有胞嘧啶(Cytosine),胸腺嘧啶(Thymine),在RNA中有胞嘧啶(Cytosine)和尿嘧啶(Uracil)。
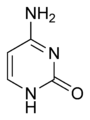
胞嘧啶

胸腺嘧啶

尿嘧啶
嘌呤为融入六元环的五元环。有腺嘌呤(Adenine)和鸟嘌呤两种(Guanine)。
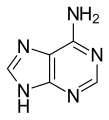
腺嘌呤

鸟嘌呤
核糖核酸的合成:连接第一个核苷酸中的糖和第二个核苷酸中的磷,构成磷酸二酯键,形成三维结构:
- RNA为单链
- DNA为双链
- 双螺旋
- 沃森与克里克
- 磷酸二酯键在外的螺旋
- 环在内有氢键链接
- 环的链接规则:
- A-T两个氢键
- G-C三个氢键
在生物中,DNA一般不以简单分子的形式存在,而往往以紧密连接的多个分子群的形式存在。这两条长链向血脉一般紧紧相连,形成一个双螺旋形。脱氧核糖核酸的结构:核苷酸的多体,核苷酸有含氮和碳元素的环,糖,PO4。几个核苷酸连成的循环固定结构同时拥有能把链连在一起的骨干,又有互相作用是DNA形成螺旋形的中央的环。
 |
DNA中的糖是戊糖2-去氧核糖。这些糖是由在环中第三个和第五个碳元素之间的磷酸二酯键链接的。键的不对称是每个键有了方向。在一个核苷酸的双螺旋中双链的方向是相反的。这种排列被叫做反平行。不对称的链的两头分别被叫做5'(five prime)和3'(three prime)。DNA和RNA只见最大的区别就在于糖,在DNA的糖有2-去氧核糖而在RNA则是一个戊糖核糖。
碱基对
碱基对是形成核酸DNA、RNA单体以及编码遗传信息的化学结构。组成碱基对的碱基包括A、G、T、C、U。严格地说,碱基对是一对相互匹配的碱基(即A:T,G:C,A:U相互作用)被氢键连接起来。然而,它常被用来衡量DNA和RNA的长度(尽管RNA是单链)。它还与核苷酸互换使用,尽管后者是由一个五碳糖、磷酸和一个碱基组成。
碱基对通常简写做bp(英语base pair),千碱基对为kbp,或简写作kb(对于双链核酸。对于单链核酸,kb指千碱基)。
無機高分子
| 本條目需要擴充。 (2010年9月19日) |
天然無機高分子
二氧化矽(水晶、石英)- 雲母
- 長石
- 石綿
合成無機高分子
- 玻璃
- 合成紅寶石
参考文献
^ Reece, Jane. Biologie 4th (french). Pearson and Benjamin Cummings. 2012. ISBN 978-2-7613-2856-2 (法语).
^ Staudinger, H.; Fritschi, J. Über die Hydrierung des Kautschuks und über seine Konstitution. Helv. Chim. Acta 1922, 5, 785–806.
^ The Origin of the Polymer Concept by William B. Jensen Journal of Chemical Education·Vol. 85 No. 5 May 624 2008
^ van Holde, K.E. Principles of Physical Biochemistry Prentice Hall: New Jersey, 1998
^ http://www.iupac.org/reports/1996/6812jenkins/6812basicterms.pdf 互联网档案馆的存檔,存档日期2007-02-23.
^ Roland E. Bauer, Volker Enkelmann, Uwe M. Wiesler, Alexander J. Berresheim, Klaus Müllen. Single-Crystal Structures of Polyphenylene Dendrimers. Chemistry: A European Journal. 2002, 8: 3858. doi:10.1002/1521-3765(20020902)8:17<3858::AID-CHEM3858>3.0.CO;2-5.
^ Minton AP. How can biochemical reactions within cells differ from those in test tubes?. J. Cell. Sci. July 2006, 119 (Pt 14): 2863–9. PMID 16825427. doi:10.1242/jcs.03063.
参见
- 高分子化学
- 高分子物理学
- 高分子材料
- 流变学
外部链接
- Synopsis of Chapter 5, Campbell & Reece, 2002
- Lecture notes on the structure and function of macromolecules
- Several (free) introductory macromolecule related internet-based courses
Template:Biological organisation
|




