分子
分子(molecule)是一种构成物质的粒子,呈电中性、由两個或多個原子組成,原子之間因化學鍵而鍵結[1][2]。能够單獨存在、保持物质的化學性質;由分子組成的物質叫分子化合物。
一個分子是由多個原子在共價鍵中通过共用電子連接一起而形成。它可以由相同的化學元素构成,如氧氣分子O2displaystyle ce O2

在不同的領域中,分子的定義也會有一點差異:在热力学中,构成物质的分子(如水分子)、原子(如碳原子)、离子(如氯离子)等在热力学上的表现性质都是一样的,因此,都统称为分子;在氣體動力論中,分子是指任何构成气体的粒子,此定義下,單原子的惰性氣體也可視為是分子[4]。而在量子物理、有機化學及生物化學中,多原子的離子(如硫酸根)也可以視為是一個分子。
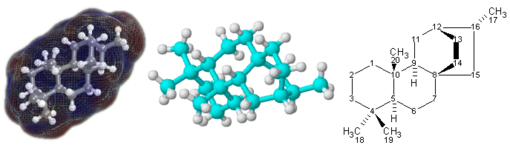
同一分子的不同畫法。左、中圖為立體模型,右圖為平面表示。(左)黑、白色球體分別代表碳、氫原子,球體間的柱體表示化學鍵。模型被一團雲包圍,代表著分子的表面,紅、藍色分別代表正、負電。(中)與左圖相似。淺藍、白色球體分別代表碳、氫原子,柱體表示化學鍵。(右)這種利用化學符號和直線來表示分子結構的畫法稱為結構式。
分子可根据其构成原子的数量(原子數)分为单原子分子,双原子分子等。
在氣体中,氫分子(H2displaystyle ce H2









許多常見的有機物質都是由分子所組成的,海洋和大氣中大部份也是分子。但地球上主要的固體物質,包括地函、地殼及地核中雖也是由化學鍵鍵結,但不是由分子所構成。在離子晶體(像鹽)及共價晶體有反覆出現的晶体结构,但也無法找到分子。固態金屬是用金屬鍵鍵結,也有其晶体结构,但也不是由分子組成。玻璃中的原子之間依化學鍵鍵結,但是既沒有分子的存在,其中也沒有類似晶體反覆出現的晶体结構。
目录
1 歷史
2 特性
2.1 分子大小
2.1.1 半徑
2.2 分子式
2.3 分子幾何
2.4 分子的電氣及光學特性
2.5 分子的磁特性
3 分子間作用力
4 相關理論
4.1 分子光譜學
5 化學、物理學及生物學中的分子
6 相關條目
7 参考文献
8 外部連結
歷史

約翰·道爾頓
分子的概念最早是由意大利的阿莫迪欧·阿伏伽德罗提出,他于1811年发表了分子学说 ,认为:“原子是参加化学反应的最小质点,分子则是在游离状态下单质或化合物能够独立存在的最小质点。分子是由原子组成的,单质分子由相同元素的原子组成,化合物分子由不同元素的原子组成。在化学变化中,不同物质的分子中各种原子进行重新结合。”[5]
在阿伏伽德罗之前,化學家約翰·道爾頓在1803年及1811年提出的定比定律及倍比定律,也支持分子學說[6],因此許多化學家接受分子學說。可是許多邏輯實證主義者及像恩斯特·馬赫、路德維希·波茲曼、詹姆斯·馬克士威、約西亞·吉布斯等物理學家不接受分子學說,認為分子只是一種方便處理的數學結構,不是實際存在的物質。一直到讓·佩蘭在布朗運動相關的研究中,才證實了分子學說。
特性
分子大小
大部分的分子无法藉由電子顯微鏡看见,最小的分子是H2,其鍵長為0.74 Å[7]。有機合成中常用到的分子大小約從數Å至數十Å。曾經製造過直徑1000 Å(100 nm)中孔氧化硅,是最大的分子[8]
一般分子雖无法由電子顯微鏡看见,但利用在特定環境下可以用原子力显微镜觀察,甚至可以觀察到一些小分子及一些原子的外觀,而像DNA是高分子化合物,就可以用電子顯微鏡看見。
大型的分子包括有高分子或超分子等。
半徑
等效分子半徑是指分子在溶液中所佔的大小[9][10]。
分子式
分子的一个特徵就是組成化合物的元素比例總是整數。例如,純水中氫和氧的比例總是2:1,乙醇中碳、氫、和氧總是以2:6:1的比例組合。利用各種元素的比例和化學符號就可以組成分子的實驗式。但是單憑實驗式是無法決定分子的類別——如乙烯的實驗式就與丙烯一樣(同是CH2),儘管這兩個分子的原子數或質量都不同。
要反映分子中各種原子的真實數量,就要利用化學式。例如乙烯和丙烯的化學式分別為C2H4displaystyle ce C2H4

分子量可以用化學式計算而得,是分子质量与12C质量的1/12之比值。若是網狀固體,則會用化學計量方式計算.稱為式量。
分子幾何
由量子力學定律的演算,分子有固定的平衡几何狀態——鍵的長度和之間的角度。純物質都是由相同几何結構的分子組合而成的。分子的化學式和結構是決定它的特質,尤其是它的化學活性的兩要素。
同分異構體是指二個化合物組成分子的種類及個數相同,但其結構不同。同分異構體有相同化學式,但因結構的不同,有不同的特質,例如乙醇和甲醚有不同的結構,但其化學式都是C2H6Odisplaystyle ce C2H6O
立體異構體是一種特別的異構體,它們可以有很相似的物理及化學性質,而由於原子在空間中的排列不同,具有相當不同的生物化學性質[11],例如維生素C有兩種立体异构体,但人體只能吸收其中一種的維生素C。
分子的電氣及光學特性
分子在電場中的特性和分子的電子分佈特性有關,包括其偶極矩及極化性。
分子的電偶極矩是指分子中正電荷和負電荷分佈的不對稱。分子若有對稱中心,例如H2displaystyle ce H2
分子的極化性是指分子因外在電場作用而改變其電子雲形狀的程度,結果會使得分子會因電場而產生電偶極矩。
分子的光學特性和其在光產生的交流電場下的行為有關,也可以用分子的極化性來得知。極化性和光的折射、散射、光學活性及其他分子光學研究的特性有關。
分子的磁特性
大部份化合物的分子及巨分子都是抗磁性。分子的磁化率χmdisplaystyle chi _m,!
有永久磁矩的分子具有順磁性,包括外層電子數是奇數個的分子(例如NOdisplaystyle ce NO
分子間作用力
分子間作用力是指電中性的分子在空間中的作用力,會隨著分子的極性而不同,其作用力相当複雜,一直到了量子力學出現後才對分子間作用力有進一步的了解。
兩個極性分子(總偶極矩不為零的分子)之間會有分子間作用力[12],可能會使分子相吸或是排斥,若分子的偶極矩沒有互相抵消,其作用力會變強。
若是一個極性分子和一個非極性分子,會有產生誘導性的分子間作用力[12]。極性分子會極化非極性分子,若極性分子的負電荷較靠近非極性分子,會誘導非極性分子,使其正電荷較靠近極性分子。
分散力是指兩個非極性分子之間的分子間作用力[12]。一般來說,非極性分子的總偶極矩為零,不過在特定時間,因為電子在分子中的分佈情形,會產生瞬時偶極。瞬時偶極可能會極化其他的非極性分子,或是兩個有瞬時偶極的分子會互相影響。
相關理論
分子物理學及理論化學的研究主要是基於量子力學,對於化學鍵的了解相當重要。最簡單的分子是氢分子离子H2+displaystyle ce H2^+

科學家們試著嚴格的定義哪些原子的組合穩定到可以視為是分子的程度,而UPAC的建議是「需對應势能面的一個低坑,而且要深到可以限制至少一個振動態。」[1]。此定義和原子之間交互關係的本質無關,和交互關係的強度有關。事實上,這也包括一些弱鍵結,以往不會視為是分子的一些原子團,例如氦二聚體He2displaystyle ce He2
原子的組合是否夠穩定到可視為分子,在本質上是操作性的定義。在哲學上,分子不是一個基本实体(相反的,基本粒子就是基本实体),分子的概念可以視為是化學家在陳述世界上原子之間作用力強度的一種敘述方式。
分子光譜學
分子光譜學是處理分子和帶有已知能量(依照普朗克關係式,也可以表示為頻率)的探測信號(或粒子)作用時,產生的頻譜。可以由分子吸收光譜或發射光譜來分析其能量交換,進而分析分子的量子化能階[14]。當像中子或電子等粒子或是高能的X光和一般規則排列的分子(如晶體)作用時,光譜學的研究一般不會指其繞射的現象。
分子的電磁及光學特性都和分子在不同狀態下的波函數及能量有關。分子光譜可以得到分子的狀態,以及在各狀態之間躍遷的機率。
分子光譜依原子的質量,位置以及原子間的交互作用有關。分子光譜和分子的轉動慣量有關,利用分子光譜,可以準確的得到原子間作用力的數值。分子光譜中線段和頻帶的數量和其分子的對稱性有關。
分子電子躍遷和分子中電子雲的結構及化學鍵的狀態有關。若分子光譜中有吸收許多在長波長可見光範圍的能量,分子會有顏色,像很多有機染料都屬於這一類。
化學、物理學及生物學中的分子
分子是化學的基礎概念,大部份有有關分子結構及功能的資訊都要透過化學研究才能得到。分子結構決定了化學反應的特性。
分子的結構及性質都是被分子物理學中研究的物理現象所影響。在物理上,分子的概念可以說明氣體、液體及固體的特性。例如分子擴散的能力、黏度、導熱係數等。第一個直接證明分子存在的實驗是在1906年由法國科學家让·佩兰,在研究布朗運動時發現的。
所有的生物都是因為分子間化學性的、非化學性的作用巧妙的平衡而存活的。對於分子結構及特性的研究是在生物學或是科學上都很重要在。
生物學、化學及分子物理學的進展產生了分子生物學,依照生物中基本化合物的結構及特性,研究生物的基本特性。
相關條目
维基共享资源中相关的多媒体资源:分子 |
- 原子
- 凡得瓦分子
- 雙原子分子
- 小分子
- 極性
- 分子结构
- 共价键
- 非共價鍵
- 化学品列表
- 星際分子列表
- 分子結構建模軟體列表
- 分子哈密頓算符
- 多原子離子
- 分子轨道
- 分子建模
- 分子設計軟體
- 超分子化學
参考文献
^ 1.01.1 (英文)國際純粹與應用化學聯合會 (1994)."molecule".《化学术语总目录》在线版.
^ Pauling, Linus. General Chemistry. New York: Dover Publications, Inc. 1970. ISBN 0-486-65622-5.
^ Molecule, Encyclopaedia Britannica on-line
^ Chandra, Sulekh. Comprehensive Inorganic Chemistry. New Age Publishers. ISBN 81-224-1512-1.
^ 自然科學概論. 五南圖書出版股份有限公司. 1996: 171–. ISBN 978-957-11-1185-8.
^ 亞佛加厥定律. 教育部數位教學資源入口網. [2014-05-09] (中文).
^ Roger L. DeKock, Harry B. Gray. Chemical structure and bonding. University Science Books. 1989: 199. ISBN 0-935702-61-X.
^ http://pubs.acs.org/doi/abs/10.1021/ac303274w
^ Chang RL, Deen WM, Robertson CR, Brenner BM. Permselectivity of the glomerular capillary wall: III. Restricted transport of polyanions. Kidney Int. 1975, 8 (4): 212–218. PMID 1202253. doi:10.1038/ki.1975.104.
^ Chang RL, Ueki IF, Troy JL, Deen WM, Robertson CR, Brenner BM. Permselectivity of the glomerular capillary wall to macromolecules. II. Experimental studies in rats using neutral dextran. Biophys J. 1975, 15 (9): 887–906. Bibcode:1975BpJ....15..887C. PMC 1334749. PMID 1182263. doi:10.1016/S0006-3495(75)85863-2.
^ IUPAC金色书对“立体异构”的定义[1](英文)。
^ 12.012.112.2 分子間作用力(Intermolecular force). 國科會高瞻自然科學教學資源平台. 2013-10-01 [2014-05-09] (中文).
^ Anderson JB. Comment on "An exact quantum Monte Carlo calculation of the helium-helium intermolecular potential" [J. Chem. Phys. 115, 4546 (2001)]. J Chem Phys. May 2004, 120 (20): 9886–7. Bibcode:2004JChPh.120.9886A. PMID 15268005. doi:10.1063/1.1704638.
^ (英文)國際純粹與應用化學聯合會 (1997,2006)."spectroscopy".《化学术语总目录》在线版.
外部連結
从维基百科的姊妹计划 了解更多有关 “分子”的内容 | |
| 维基词典上的字词解释 | |
| 维基共享资源上的多媒体资源 | |
| 维基语录上的名言 | |
| 维基数据上的数据项 | |
- Molecule of the Month – School of Chemistry, University of Bristol
Template:Molecules detected in outer space
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||
|