相 (物质)

快速熔化中的氬冰塊展示出從固體到液體的相變。
假設一個系統是由一種物質均勻組成,擁有均勻的物理與化學性質,則稱這系統只具有一種相(英语:Phase)。這是一種簡單的系統,稱為均相系統。更複雜的系統可能在某方面不均勻,這類系統稱為非均相系統。在做分析時,可以將非均相系統分為幾個系統,每個系統都只具有一種相,都是均相系統[1]:86[2]:3。例如,經過仔細攪和後的溶液是均相系統,只具有一種相。又例如,在一個裝有水和冰塊的玻璃杯所組成的非均相系統中,水是一種相、冰塊也是一種相,水上方的潮濕空氣是另一種相,而玻璃杯又是另外一種相。
每一種相都是一種物质状态;但相和物质状态不同,在同一種物质状态中,可能會存在一種以上彼此不混溶的相。相有時會用來描述由相圖上的相邊界劃分出來的一組平衡狀態;在這裡,相邊界是由像壓力、溫度一類的狀態變數設定。相邊界很重要地關聯到在它兩邊的兩種相所對比出的性質差異。例如,由液體變成固體、由某一種晶體結構變為另一種晶體結構。
目录
1 相的分類
2 相平衡
3 相的數量
4 界面現象
5 晶相
6 相變
7 進階定義
7.1 对自由能的分析
7.2 相关的热力学参数
7.3 亚稳定的相
8 相图
9 形成和万能性
10 相的分离
11 参见
12 註釋
13 參考資料
相的分類
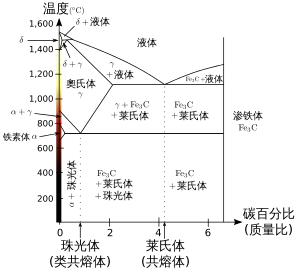
鐵-碳合金的相圖展示出形成各種不同相所需的條件。
相可以用常见的物质状态來描述,像固态、液态和气态、等离子态、玻色-爱因斯坦凝聚态等。在固相與液相之間的中間相形成另一種物質狀態,中間相物質是一種很有用的材料。但在同一個物质状态中也會存在不同的相,例如在鐵-碳合金的相圖中,存在許多物質狀態都是固態或液態的各種不同的相,例如萊氏體、奧氏體、珠光體等。
在溶液裏,溶質對於溶劑在溶解度方面的不同,使得可區分的相的出現成為可能,例如,水(極性分子)在油(非極性分子)中的溶解度很低,而油在水中的溶解度也很低,由水和油形成的混合物,因為二者不互溶,會自然分為二個相,並因此出現清楚的界面。兩種物質的互溶度與它們彼此之間的的分子間作用力有關。一般而言,假若溶質A能夠溶解於溶劑B,則在它們組成的溶液裏,分子間吸引力KAB必須能克服KAA與KBB。分子間吸引力與分子的極性或非極性有關,例如,假若溶質A、溶劑B都是非極性物質,即KAA、KBB都很弱,而KAB也很弱,則溶質A在溶劑B的溶解度可能很高;假若溶質A、溶劑B都是極性物質,即KAA、KBB都很強,而KAB也很強,則溶質A在溶劑B的溶解度可能很高[3]:10-11。
類似的概念可以延伸到固體,固體可以形成固溶體,或者結晶形成不同的晶相。互溶的金屬對(metal pair)可以形成合金;無法互溶的金屬對不能形成合金。
舉例而言,化學實驗家已完成展示不互熔性的實驗。在這實驗裏,可以觀察到八種不互熔的相,一層一層的堆排在容器內 ,按照密度從小至大,分別為石蠟油、矽油、水、苯胺、全氟二甲基环己烷、熔融白磷、熔融鎵、水銀。在磷與鎵都會熔化的溫度45°C,這系統呈長久穩定平衡[3]:12。
不是所有有機溶劑都可以彼此互溶,例如乙二醇和甲苯都是有機溶劑,但會分為二個不同的相[4]。
有時候不同的相會自動分離,有清楚的界面,但有時不同的相不一定會有清楚的界面,像乳浊液和膠體都是不互溶的二相形成的混合物,但沒有清楚的相邊界。
2012年加拿大佩里米特理论物理研究所研究员文小刚在美国《科学》杂志的发表文章提出一种能够最终对相进行分类的新理论体系,物质有500多种相。该理论可以在任何维度、任何对称性的基础上对保有对称性的相实施构筑和分类。[5]
相平衡
在相平衡時,許多的成份可能會形成均勻的一相,但單一相質也有可能在特定溫度及壓力下分為二個或三相不同的相,同一相的物理性質一樣,但相和相之間的物理性質就不同了。
假設在密閉罐子中的水只佔有一部分空間,則會形成兩相,大部份的水是處於液相,靠水分子之間的吸引力而維持液相,但即使在相平衡時,分子仍然在運動,若某一個水分子獲過夠大的動能,就會打破水分子之間的吸引力,由液相變為氣相,當一個水蒸氣分子和水面碰撞,也會凝結成水。在平衡時,水蒸發和凝結的速度相同,液相及氣相的體積都不會改變。
在室溫及一般大氣壓力下,當罐中空氣的濕度到3%時,水和水蒸氣達到平衡。當溫度升高,平衡時的濕度也會上昇。在溫度100%時,水會全部變成水蒸氣時,若加熱略超過100度,不只液體表面的水分子會氣化,液體水整體都會氣化,稱為沸騰。
相的數量
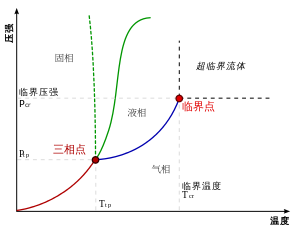
典型的相包括固相、液相与气相,根据其与压力及温度的关系,可绘成相图。图中绿色实线是一般物质在不同温度及压力下的凝固/熔解曲线,绿色虚线是水的凝固/熔解曲线,显示出当压力增加时会出现的反常行为。
給定一種組成,在特定溫度及壓力下只有某些相可以存在。相的數量及種類很難預估,一般都是用實驗來求得,實驗的結果會繪成相圖。
右圖是單一成份的相圖,注意到系統的狀相只和溫度及壓力有關,圖中繪出兩相或三相共存的條件,只要溫度或壓力偏離該條件,平衡狀況下就只有一相。
圖中的藍線是液氣共存的線段,但終止於一個稱為臨界點的溫度及壓力。當溫度及壓力接近臨界點時,液相和氣相的性質會越來接近,在臨界點時無法區分液相和氣相,溫度及壓力一旦超過臨界點,就沒有單獨可區分的液相或氣相,只會有一種稱為超臨界流體的流體相。水的臨界點是647K(374 °C)及22.064MPa。
在水的相圖中,一個特殊之處為其固液共存的線段(綠色點線)。對於大部份的物質,這條線的斜率為正值(綠色實線),表示若要維持固相和液相共存,溫度升高,壓力就大。但對於水這條線(綠色點線)的斜率為負值,這和冰的密度比水要低有關,將冰加壓會使冰成為密度較高的相,也就是水。
另一個值得注意的特性是液氣共存線、固液共存線彼此相交的點,稱為三相點,在此溫度及壓力下,三相會共存
在實驗方面,平衡線不難繪製,這是因為對於多相系統,溫度與壓力無關。試想由密閉隔溫罐子與活塞組成的一個檢試儀器,假設注入正確數量的水,加熱,則這系統可以被帶到相圖的氣相區域內的任意點。這時,假若用力將活塞緩慢推入罐子,則這系統會在相圖的氣相區域描繪出一條溫度增加與壓力增加的曲線。但是,假若這條曲線遇到液相-氣相平衡線,即氣體開始凝聚成液體的情況,則這系統之後描繪出的曲線會驟然地重疊於液相-氣相平衡線,直到所有水氣體都凝聚成水液體。
界面現象
在平衡的二相的邊界之間,會有一狹窄區域,其性質和這二相都不同,雖然此區域可能非常狹窄,它可能造成顯著與容易觀測到的效應,例如促使液體展示出表面張力。混合物的某些成分可能比較喜歡移動至界面。為了建模、描述或了解某特定系統的物理行為,將界面區域視為獨立分開的一相是個很好的點子。[2]:208-212
晶相
同一種物質在固體時可能會有不止一種的相,以水為例,常見的冰是六邊形的結構冰Ih,但也可能會有立方體的結構冰Ic、三方晶系的結構冰II以及其他的結構。
多形體是指一個固體有不只一種的晶體型式,由一種化學元素組成的多形體則稱為同素异形体。例如石墨、鑽石及富勒烯都是碳的同素异形体[6]。每一種多型體都是獨立的晶相。
相變
相變是指一物質由一個相轉變為另一個相,
- 一級相变:當中會伴隨著熱量的吸收或釋放,及體積、比热容、压缩率等會有变化[7]。例如水蒸發時,蒸發的水分子有較高的動能,因此液體的溫度會下降。產生相變需要的能量(汽化熱)要比將水由室溫加熱到沸點的能量要多,因此蒸發有助於冷卻。相反的,凝結會放熱。從固相變為液相的熱能(或焓)變化稱為熔化熱,而由固相變為气相的熱能(或焓)變化稱為為升華熱。
- 二級相变:其體積沒有明顯的變化,沒有潛熱產生,熵也沒有不連續的變化。像超导体在临界温度时发生第二种相变,无相变潜热,但是物质的其他性质会发生变化(导电性等)。
重要的相變還有氦-4在临界温度时Lambda相變为无粘滞的超流体、磁鐵在居里溫度從鐵磁性變成順磁性、金屬-絕緣體相變、量子相變等。
進階定義

基礎三相
对自由能的分析
虽然相的概念从表面上来看非常简单,但要对它作一个精确的定义却很困难。一个比较好的定义是一个相是一个在其范围内其热力学参数的自由能在参数空间中的函数是解析的。这个定义实际上就是说,假如两个系统是同一个相的话,那么在从一个系统转换到另一个系统的时候它们的热力学参数不会突然改变。
热力学中的参数如熵、热容量、壓縮性等都可以被表示为自由能和它的导数。比如熵是自由能对温度的导数。只要自由能是解析的,那么热力学的其它参数也是连续的。
假如一个系统从一个相演变为另一个相,那么在这个过程中总会有一个阶段里自由能是不解析的。这个过程被称为相变。最常见的相变有溶化(从固态到液态)、冻结(从液态到固态)、蒸發(从液态到气态)和凝结(从气态到液态)。由于自由能在这个过程中是不解析的,因此在这个过程的两边它是两个完全不同的函数。两个相的热力学参数也完全不同。最显著的是热容量,在相变过程中热容量可以达到无穷大,从一个值跳到另一个值。
相关的热力学参数
实际上每个相与另一个相之间总有一些相关的热力学参数非常不同。比如固体比液体要坚固得多,固体不像液体或气体那样,它可以保持它的形状。而液体则比气体的压缩性小得多。在一个大的容器中,气体可以充满整个容器,而液体则只占据一小部分。固体、液体和气体之间也有许多相同的热力学特性,比如它们的磁特性。但一个物质的铁磁态和顺磁态之间最大的区别就是它们的磁特性了。
另一个例子是同素异形体,许多物质在固态中可以有不同的晶体结构而具有非常不同的特性。钻石和石墨就是碳的同素异形体。从热力学的角度出发它们属于不同的相。
亚稳定的相
亚稳定的状态有时也被看作是相,但精确地说它们并非相,因为它们不稳定。比如一些同素异形体只有在一定的条件下才稳定。取以上提及的碳为例,钻石只有在高压下才真正稳定。在一般的大气压和温度下钻石会缓慢地转变为石墨。但这个过程非常缓慢,因此在常温和常压下钻石是一种亚稳定的状态。假如温度加高的话,这个转化的过程就会加快。
相图
一般人们用相图来表示一个系统的不同相。相图的轴是相关的热力学参数。简单的相图的轴是压强和温度。根據對應狀態原理,使用約化坐標來繪製,所有簡單物質的相圖應該都很類似[2]:208-212[註 1]。
相图上的线被称为“相邊界”,这是自由能不解析的地方,或者说相变发生的地方。而没有线的地方则是自由能解析的地方。这些地区属于同一个相。有些相的相邊界不是在一切情况下都存在的。比如在647K和22.064兆帕斯卡以上水的液态和气态无法区分,液态和气态的相界在这个点就中断了。
形成和万能性
相是一种宏观现象。组成一个系统的粒子假如比较少的话(一般少于1000)相的差别就消失了。其原因是只有在大的系统中系统的自由能才开始不解析。
相的另一个特性是它的万能性。不论一个宏观系统下的微观系统是怎样组成的,它们的相有非常类似的特性。比如铁和冰都是固态的,虽然从微观结构来说冰和铁的结构非常不同,但它们的固态都具有类似的特性,比如保持它们的形状。
相的分离
在同一个系统中不同的相可以同时存在。一般来说它们之间有分明的边界,但也有例外,像乳浊液和膠體都是不互溶的二相形成的混合物,但沒有分明的邊界。
约西亚·吉布斯[8][9]提出的吉布斯相律如下:
- F=C−P+ndisplaystyle F;=;C;-;P;+;n
其中,
Fdisplaystyle F,表示系统的自由度,
Cdisplaystyle C:系統的独立組元數
Pdisplaystyle P:相數目
ndisplaystyle n:外界因素,多數取n=2,代表壓力和溫度。
若系統只有一種物質,C=1displaystyle C=1



参见
- 相边界
- 相列表
- 相变
- 相转移催化剂
- 相圖
- 物質狀態
註釋
^ 約化坐標是變量除以臨界變量,例如,約化溫度是溫度除以臨界溫度。[2]:267
參考資料
^ Enrico Fermi. Thermodynamics. Courier Corporation. 25 April 2012. ISBN 978-0-486-13485-7.
^ 2.02.12.22.3 Clement John Adkins. Equilibrium Thermodynamics. Cambridge University Press. 14 July 1983. ISBN 978-0-521-27456-2.
^ 3.03.1 Reichardt, C. Solvents and Solvent Effects in Organic Chemistry. Wiley-VCH. 2006: 9–10. ISBN 3-527-60567-3.
^ 此一現象有助於赫克反应中催化劑的回收再利用,參照Bhanage, B.M.; 等. Comparison of activity and selectivity of various metal-TPPTS complex catalysts in ethylene glycol — toluene biphasic Heck vinylation reactions of iodobenzene. Tetrahedron Letters. 1998, 39 (51): 9509–9512. doi:10.1016/S0040-4039(98)02225-4. 引文格式1维护:显式使用等标签 (link)
^ X. Chen, Z.-C. Gu, Z.-X. Liu, X.-G. Wen. Symmetry-Protected Topological Orders in Interacting Bosonic Systems. Science, 2012; 338 (6114): 1604 DOI: 10.1126/science.1227224
^ 成會明. 奈米碳管. 五南圖書出版股份有限公司. 2004: 14–. ISBN 978-957-11-3499-4.
^ 近代物理学进展. 清华大学出版社有限公司. 1997: 166–. ISBN 978-7-302-02521-4.
^ Gibbs, J.W., Scientific Papers (Dover, New York, 1961)
^ Atkins, P.W.; de Paula, J. Physical chemistry 8th. edition. Oxford University Press. 2006. ISBN 0198700725. 引文使用过时参数coauthors (帮助) 引文格式1维护:冗余文本 (link)Chapter 6
^ (英文)國際純粹與應用化學聯合會 (1994)."Triple point".《化学术语总目录》在线版.
| ||||||||||||||||||||||||||||||||||||

